Wo und wie kann ich sie finden?
- Methoden der Kartierung und die wichtigen Lebensräume
- Die Kultivierungstechnik der Feuchtkammer
Methoden der Kartierung und die wichtigen Lebensräume:
In der mobilen Phase ihres Lebens ernähren sich Myxomyceten hauptsächlich räuberisch von Bakterien. Sie kommt in sehr verschiedenen Lebensräumen vor und phagozytieren ihre Beute, solange die Feuchtigkeit ausreicht um sich Fortzubewegen. Bei Ausbildung der Fruchtkörper bleiben sie ihrem Standort treu. Die Arten versuchen ihre Sporokarpien (Fruchtkörper) auf eine, sich in ihrer Reichweite befindliche leichte Erhöhung zu platzieren, um die Reifung, Trocknung und anschließende Verbreitung der Sporen zu gewährleisten.
Wir haben das potenzielle Vorkommen von Schleimpilzen in verschiedenen Lebensräumen untersucht. Da sie oft in großen Gruppen wachsen, ist es leicht sie zu entdecken. Mit Hilfe der 10-fachen Vergrößerung einer Lupe kann man die ersten wichtigen Bestimmungsmerkmale erkennen. Die Bestimmung wird nach der Probenentnahme im Labor fortgesetzt, indem der Fund mit 9- bis 80-facher Vergrößerung einer binokularen Nikon Lupe und anschließend mit einem Realux BK 5000-Mikroskop mit den Vergrößerungen 40, 100, 200, 400 und 1000 mit Immersionsöl genauer untersucht wird. Die Proben, welche unter dem Mikroskop untersucht werden, werden im Allgemeinen mit reinem Wasser präpariert, in einigen Fällen mit Hoyers Konservierungsmittel.
Der Lebensraum Wald stellte sich eindeutig als der Artenreichste heraus, wobei das Totholzvorkommen hier das wesentliche und unverzichtbare Element darstellt. Die Zweige und umgekippten Baumstämme am Boden beherbergen 70 Prozent der von uns identifizierten Arten. Die Sporokarpien befinden sich meist an ihrer Unterseite, manchmal auch im Inneren des Totholzes, wobei der kleinste Riss genügt. Seltener wachsen sie auf sehr spektakulärer und auffälliger Art und Weise auf der Oberfläche von Baumstämmen, wie dieses reizende Exemplar im Hagenauer Wald.
Einige Arten besiedeln eine sehr breite ökologische Nische, andere sind mehr oder weniger spezialisiert. Physarum alba zum Beispiel wurde auf ganz verschiedenen Holzarten gefunden. Auf Holz mit Rinde oder ohne, Laub- oder Nadelbaum, frischem Totholz oder welchem in vorgeschrittenen Zersetzungsstadien, an dünnen Zweigen oder an Baumstämmen großen Durchmessers, auch direkt auf Laubstreu. Badhamia utrucularis hingegen, konnten wir nur an Hartholz wie dem der Hainbuche oder oft auch an frisch gefällten Eichen beobachten.
In den Erlenhainen konnten wir eine Reihe von stark spezialisierten Arten dokumentieren, beispielsweise Comatricha rutilipeda, welche ausschließlich auf verharzten Erlenzapfen (Alnus glutinosa) vorkommt.
Manchmal wird auch lebende Vegetation besiedelt, ohne ihr dabei Schaden zuzufügen, da sie nur eine unterstützende Rolle spielt. Auch hier finden wir Arten, welche ganz unterschiedliche Nischen besiedeln, andere hingegen sind Spezialisten. So finden man Didymium melanospermum häufig auf den Stängeln von Polytrichum formosum um ihre Sporokarpien über die Moosschicht zu heben. Die Art kommt ebenfalls auf anderen Bryophyten und auch auf Totholz vor. Im Gegensatz zu der breiten ökologischen Nische welche Didymium besiedelt, ist Diderma ochraceum ausschließlich auf Felshängen, auf dem Dreilappigen Peitschenmoos Bazzania trilobata anzutreffen.
Die Rinde lebender Bäume ist ebenfalls ein passender Lebensraum, da die kleinen Spalten und Risse in ihr winzigen Myxomceten Arten Schutz bieten können. Auch hier sind einige Arten Ubiquisten, andere bevorzugen ausschließlich Harthölzer oder Nadelbäume. Eine Art hat Fichten Wunden als ihre einzige Heimat gewählt, in welchen Harz um einen anamorphotischen Pilz fließt, dessen Namen uns noch nicht bekannt ist.
In reinen Waldgebieten haben wir einen besonderen Fokus auf Mikrohabitate gelegt:
- Lianen: die Waldrebe (Clematis vitalba, C. viticella), die Weinrebe, (Vitis vinifera), die Jungfernrebe (Parthenocissus sp), Efeu (Hedera helix) und Hopfen (Humulus lupulus). Auf ihnen fanden wir 5 Prozent der Arten, welche im Naturpark Nordvogesen vorkommen, einschließlich Licea eleanorae, eine Art, die an noch keinem weiteren Standort nachgewiesen wurde. Im Botanischen Garten Straßburg findet man einige Clematis Individuen, auf denen wir Protophysarum phloiogenum das erste Mal in Frankreich dokumentieren durften.

Clematis tibetana subsp. vernayi Straßburger Botanischer Garten
- der Rinde lebender Bäume, in verschiedenen Umgebungen wie Gärten, Obstgärten, Hecken oder Parks in städtischen Gebieten: 10 Prozent der Myxomyceten Arten des Naturparks Nordvogesen kommen hier vor, von denen fünf bislang in keinem anderen Lebensraum beobachtet wurden.
- der lebenden oder vertrockneten halbverholzten Pflanzen: auf Lavendel (Lavandula angustifolia, L. stocheas, L. dentata) und Mauerblümchen (Erysimum sp.), auf welchen 5 Prozent der Arten des Naturparks Nordvogesen vorkommen, von denen sieben Arten in keinem anderen Habitat anzutreffen sind.
- Verschiedene kompostierte Pflanzenreste: Dort fanden wir nur häufig vorkommende Arten, mit Ausnahme von Fuligo cinerea, welche wir nur auf dieser Art des Substrates vorfanden.
- dem Kot von Pflanzenfressern: Pferd, Hirsch und Hase. Eine seltene Art wurde 2010, 2011 und 2012 auf Pferdemist nachgewiesen.
- Der Pestwurz (Petasites hybridus): Es sind drei Arten bekannt, welche unter den Blättern der Pestwurz wachsen. Dies scheint der einzige Lebensraum dieser Arten zu sein. Zwei der Arten, Didymium tussilaginis und vernum, werden hier vorgestellt. Trotz jährlicher Recherche im Frühjahr konnten wir die dritte, Diacheopsis sp., 2014 von Andreas Kuht beschrieben aber noch nicht benannt, noch nicht beobachten (KUHNT A. & al., 2014).
10 Prozent der Arten im Naturpark Nordvogesen findet man in den folgenden drei Lebensräumen: im Kompost, auf Kot oder an der Pestwurz.
Unter diesem Link fassen wir Art für Art, Beispiele von Funden in den nördlichen Vogesen, mit ihrem dazugehörigen Substrat und ihrem Habitat zusammen. In einer bestimmten Umgebung, oder genauer gesagt, in einem bestimmten Klima, leben Arten welche sich von Bakterien ernähren, die den Wasserfilm zwischen Boden und dicken Schneeschichten besiedeln. Wir sprechen von nivicolen Arten. Dieses Thema behandeln wir hier.
Die Kultivierungstechnik der Feuchtkammer
Um den Artenbestand möglichst vollständig erfassen zu können, genügen die Untersuchungen allein im Feld nicht. Viele Arten sind zu klein, um auf diese Weise erfasst werden zu können, weshalb wir die so genannte Feuchtkammer verwenden um die Arten zu kultivieren. Diese Methode wurde 1933 von Gilbert und Martin entwickelt und wird systematisch bei der Bestimmung angewandt. Das Prinzip dieser Methode besteht darin, Substrate, auf welchen sich möglicherweise Sporen oder Sklerotien befinden in eine Umgebung zu bringen, welche eine hohe Luftfeuchtigkeit aufweist. Dafür eignet sich beispielsweise eine Petrischale, in welcher die Luftfeuchtigkeit künstlich hochgehalten wird. Wir verwenden Kunststoffboxen mit den Maßen 15 x 10 x 4 cm, in denen größere Proben platziert werden können. So schaffen wir Verhältnisse, welche den natürlichen Bedingungen eher entsprechen, als denen die wir in Petrischalen erzeugen könnten. Die Abdeckung wird ohne weiter abgedichtet zu werden auf die Kunststoffbox gelegt, um einen Gasaustausch mit der Umgebungsluft zu ermöglichen. Der Boden wird mit saugfähigem Papier ausgelegt, welches regelmäßig mit einer Sprühflasche befeuchtet wird. Es wird einfaches Leitungswasser bei Raumtemperatur aus der Oberbronner-Quelle genutzt. Alle vier bis fünf Tage wird das Medium mit einem Binokular untersucht.
Manchmal bilden sich die ersten Plasmodien oder Myxomyceten nach einigen Tagen, der Rekord von drei Tagen wird von Protophysarum phloiogenum auf Clematis flamulla gehalten, meistens dauert es jedoch vier bis fünf Wochen.
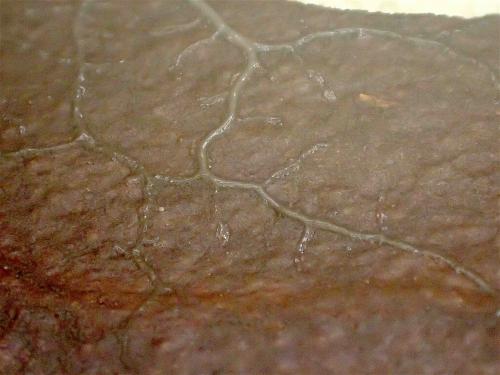
Es kommt vor, dass Plasmodien keine Früchte tragen. Entweder sterben sie, sie bilden keine Sporen aus oder verharren auf unbestimmte Zeit im plasmodialen Zustand. Ein Beispiel dafür ist unten zu sehen: ein Stück Rinde, welches an einer lebenden Waldkiefer am 15. September 2017 im Hanauer Wald gesammelt und am selben Tag in der Feuchtkammer ausgelegt wurde. Am 05. Dezember 2017 entwickelte sich das Plasmodium. Zuerst war es winzig und durchsichtig, als es wuchs wurde es allmählich trüb. Es bewegte sich über die Rinde und durch die Feuchtkammer, bildete jedoch keine Fruchtkörper aus. Am 21.Mai 2019 starb er und hinterließ nur einige bräunliche Klumpen am Boden der Kammer.
 17 mars 2019 |
|
 17 mars 2019 |
 17 mars 2019 |
Die Substrate, welche in Feuchtkammern untersucht wurden:
- Rinde, gesammelt an lebenden Bäumen, Beispiele im Naturpark Nord Vogesen: Sechs Proben an vier Standorten trugen drei Arten, die an keinem weiteren Standort beobachtet werden konnten. Dies deutet auf ein erhebliches Potential der Methode hin. Die Durchführung sollte in einem größeren Ausmaß wiederholt werden.
- Lianen
- Lavendel und Mauerblümchen
- Fäkalien von Herbivoren
Im Naturpark Nord Vogesen: 22 Arten wurden ausschließlich anhand der Feuchtkammermethode nachgewiesen, das umfasst in etwa 18 Prozent der Vorkommenden Arten.
Wie auch bei den Untersuchungen im Gelände, werden fortlaufend neue Proben und Substrate gesammelt, um sie in der Feuchtkammer zu kultivieren, sodass regelmäßig die ein oder andere neue Art entdeckt werden kann.








